Espectro de emisión
(Redirigido desde «Espectro de emision»)
Ir a la navegaciónIr a la búsqueda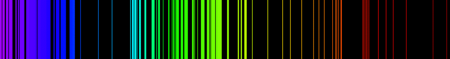
Espectro de emisión del hierro
Características[editar]
Las características del espectro de emisión en algunos elementos son claramente visibles cuando estos elementos son expuestos al fuego o una temperatura muy alta. Por ejemplo, cuando un alambre de platino es bañado en una solución de nitrato de estroncio y después es introducido en una llama, los átomos de estroncio emiten color rojo. De manera similar, cuando el Cobre es introducido en una llama, ésta emitirá una luz muy potente. Estas caracterizaciones permiten identificar los elementos mediante su espectro de emisión atómica.El hecho de que sólo algunos colores aparezcan en las emisiones atómicas de los elementos significa que sólo determinadas frecuencias de luz son emitidas. Cada una de estas frecuencias están relacionadas con la energía de la fórmula:
- es la energía del fotón
- es la constante de Planck
- es la frecuencia
La frecuencia es igual a:
- es la velocidad de la luz en el vacío
- es la longitud de onda
Las frecuencias de luz que un átomo puede emitir depende de los estados en que los electrones pueden estar. Cuando están excitados, los electrones se mueven hacia una capa de energía superior. Y cuando caen hacia su órbita normal emiten la luz.







No hay comentarios:
Publicar un comentario